琉球大学のトーマ・クラウディア准教授・大倉信彦助教、東北大学の中村修一助教、沖縄科学技術大学院大学(OIST)のブルーノ・ホンベル博士らの研究チームによる成果が、2021年4月16日に英国の学術雑誌「Cellular Microbiology」誌のオンライン版で公開されました。
<発表のポイント>
- レプトスピラ症を引き起こす細菌、レプトスピラは、川のレジャーなどで皮膚や粘膜から血流に入り、標的臓器へと広がりますが、そのメカニズムは不明でした。
- 感染が起こる臓器では、隣り合う細胞どうしが「細胞をシールする装置」によって密着することで臓器の構造と感染阻止を含む生理機能が維持されています。
- 本研究グループは、感染が起こるときに、レプトスピラが細胞をシールする装置を壊すことを明らかにし、さらにその破壊を阻止することに成功しました。
- レプトスピラによる臓器破壊の仕組みを解明したことから、新規治療薬開発への応用が期待できます。
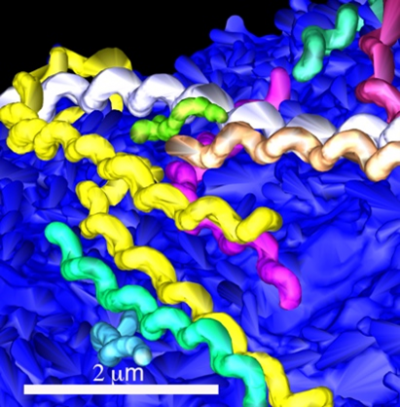
細胞に付着するレプトスピラ.
当該論文Sebastián et al., Cellular Microbiology, 2021より改編
【研究の背景】
レプトスピラ症は熱帯・亜熱帯地域に多く見られる人獣共通感染症の一種です。感染症法で届出対象とされていますが、その臨床症状には発熱や筋肉痛など軽症型から黄疸・出血症状・多臓器不全などを伴う重症型まで多様性があるため、確定診断が難しい感染症として知られています。初診が遅れ重症化すると死に至ることもあります。沖縄県での患者発生は他県に比べ多く(届出件数の半数が沖縄)、河川でのレジャーによる集団感染の報告も多数あります。レプトスピラ症の治療としては抗菌薬による早期治療が効果的ですが、抗菌薬の投与による副作用などが問題となっており、新たな治療法の開発が求められています。
レプトスピラ症の原因細菌であるレプトスピラは、皮膚・粘膜から血流に入り、肺や腎臓などの標的臓器へと拡がります。一方、皮膚や臓器にはもともと細胞間接着装置(接着装置)があり、隣り合う細胞どうしを密着させることで、臓器の構造と感染阻止を含む生理機能を維持しています。接着装置は、カドヘリン(1)を中心分子とする接着帯と閉鎖帯から構成されています。さらに、閉鎖帯は、細胞膜に存在するタンパク質(オクルディン)と細胞内裏打ちタンパク質などから構成されています。病原細菌は様々な戦術を駆使して、これらのタンパク質の機能を撹乱し、感染を成立させます。レプトスピラの場合は、細胞間隙を通過しながら肝臓・肺・腎臓などの標的臓器にたどり着くことが動物感染モデルを用いた研究で示唆されていましたが、その仕組みは未解明のままでした。
【研究成果の概要】
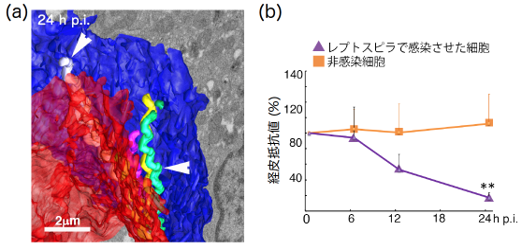
レプトスピラがどのように標的臓器に辿り着くかを理解することは、レプトスピラ症の重症化と本菌の全身への広がりを遮断するために重要です。そこで、我々は、近位尿細管上皮細胞(2)(renal proximal tubular cells, RPTEC)を安定した経上皮抵抗(3)値を示す細胞として分化させた実験系を立ち上げました。この実験系を用いて、レプトスピラを基底側から感染させ、FIB-SEMトモグラフィ法(4)にて感染の現場をスナップショットで捉えることに成功し、感染24時間後には多数のレプトスピラが細胞間隙に存在することがわかりました(図1、図2)。さらに、レプトスピラの動態を理解するために、継時的にビデオ顕微鏡によるモニタリングや上皮細胞の構造と抵抗値などを解析しました。その結果、レプトスピラの細胞への付着上昇に伴い、抵抗値が低下することが分かりました(図2)。

近位尿細管上皮細胞(RPTEC)はTranswell(5)にて培養し、基底側からレプトスピラで感染させた。継時的にRPTECのバリア機能、レプトスピラの運動性・局在と細胞間接着装置の構造を解析した。当該論文Sebastián et al., Cellular Microbiology, 2021より改編。
また、低い抵抗値を示す細胞では、カドヘリンとオクルディンの膜タンパク質の局在の著しい変化が誘導されました。これらの結果により、レプトスピラは接着装置を破壊し、細胞間隙を通過しながら上皮細胞の頂端側へと移行することが明らかになりました。
次に、レプトスピラの接着装置破壊機構を明らかにするために、様々の阻害を用いた感染実験を行いました。その中で、カドヘリンの細胞内取り込みを阻害するPitstop2(6)を用いた感染実験では、レプトスピラによる接着装置の破壊と(図3)、レプトスピラの頂端側への移行を阻止することができました。この結果から、レプトスピラによる細胞間接着装置の破壊は、その接着に重要な細胞外領域をもつカドヘリンを細胞内に取り込むことで引き起こされることがわかりました(図4)。
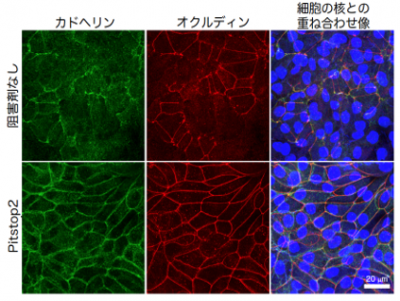
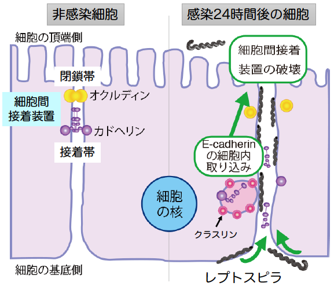
① 基底膜側の細胞膜へ付着
② 細胞表面で運動
③ カドヘリンの細胞内取り込みの誘導
④ オクルディンの局在変化
⑤ 細胞間接着装置の破壊
当該論文Sebastián et al., Cellular Microbiology, 2021より改編。
【研究成果の意義】
体内に侵入したレプトスピラは、コルク栓抜きのような形状で運動しながら組織内を移動すると考えられています。レプトスピラは、発熱後7日間程度血液中に存在しますが、10日前後でレプトスピラに対する抗体が産生されるため菌は排除されます。しかしながら、菌は腎臓の近位尿細管に留まって長期にわたり尿中へと排出されます。これまでは菌がどのように全身へと移行するかが理解されていませんでした。
本研究で用いた実験系では、動物感染モデルと同様、レプトスピラが細胞間隙を移動することを初めてin vitro(7)で再現できたことによって、レプトスピラがカドヘリンの細胞内取り込みを誘導し、細胞間接着装置を破壊することが明らかになりました。従って、カドヘリンの細胞内取り込みを阻害することによってレプトスピラの全身への広がりを食い止められることが示唆されました。本研究で得られた新規知見は、レプトスピラ症の病態形成メカニズムの理解に寄与し、新たな制御法の開発につながることが期待できます。
【用語解説】
(1)カドヘリン:細胞膜を貫通するタンパク質で、細胞外領域が細胞表面に突き出ており、同じカドヘリン分子同士が結合することによって、向かい合う細胞膜を接着させる。
(2)近位尿細管上皮細胞:腎臓の糸球体の近くにある尿細管の細胞。内腔側の細胞膜は微絨毛によって、著しく面積を増しており、大量の再吸収を行う細胞である。
(3)経上皮抵抗:上皮細胞では細胞接着装置によって頂端側と基底膜側との間で電気抵抗が生じる。経上皮抵抗は上皮細胞の機能を評価する方法として用いられる。
(4) FIB-SEM トモグラフィ法: 集束イオンビーム(FIB)と走査電子顕微鏡(SEM)を組み合わせ、細胞と細菌の相互作用などを3次元的に可視化する手法。
(5) Transwell: 生体内により近い細胞培養環境を実現するために用いられる装置。頂端側と基底膜側から培地供給できるので、自然な方法で極性を持つ細胞として上皮細胞を分化させることが可能。
(6) Pitsotp2:細胞内取り込みに関与するタンパク質、クラスリンに対する選択的阻害剤。クラスリンは、細胞内取り込みの小胞形成に必須である(図4)。
(7)in vitro:試験管や培養器などの中で、体内と同様な環境を人工的に作り行われた実験のことを指す。
【研究体制と支援】
本研究は、琉球大学大学院医学研究科(細菌学講座、分子解剖学講座)、沖縄科学技術大学院大学(イメージングセクション)、東北大学大学院工学研究科の共同研究として行われました。
また、科研費(18H02655、21H02732、18K07100、18J10834)の支援を受けました。
【論文情報】
論文タイトル:Disassembly of the apical junctional complex during the transmigration of Leptospira interrogans across polarized renal proximal tubule epithelial cells
(和訳)病原性レプトスピラによる近位尿細管上皮細胞の細胞間接着装置の破壊戦略の解明
雑誌名: Cellular Microbiology
著 者: Isabel Sebastián1, Nobuhiko Okura1, Bruno M. Humbel2, Jun Xu1,3, Idam Hermawan1, Chiaki Matsuura1, Malgorzata Hall2, Chitoshi Takayama1, Tetsu Yamashiro1, Shuichi Nakamura3 and Claudia Toma1*
* Corresponding author
1 琉球大学大学院医学研究科、2 沖縄科学技術大学院大学、3 東北大学
DOI番号: 10.1111/cmi.13343
URL: https://onlinelibrary.wiley.com/doi/abs/10.1111/cmi.13343